�z�[�� ���j���[ ![]() �M�Ǝd�� �C�̖̂@�� �C�̕��q�^���_ �����G�l���M�[ �C�̂̏�ԕω� �s�t�ω�
�M�Ǝd�� �C�̖̂@�� �C�̕��q�^���_ �����G�l���M�[ �C�̂̏�ԕω� �s�t�ω�
�y�P�Q�z�M�Ƃ�
�M�Ɋւ������I�Ȍ��ۂŎ��̂悤�ȋ^�₪����B
�u�H���Ɏg����͂����̂��̂͑z���ȏ�ɒg�����������ł���B���C�̓��͓��������g���Ă��Ȃ���C���ʂ������قǗ�߂ɂ����B�①�ɂ�N�[���[�͂Ȃ���₳���̂��B�j����S�̖_�ŏ\���C�����邾���ŁC��ł����Ȃ��قǍ����ɂȂ�v�B
�������ǂ̂悤�ɐ������邱�Ƃ��ł��邾�낤���B������M����Ɖ��x���オ������C�c��������C�ő̂���t�̂ւ� ��Ԃ�ς����肷��B�M�͊w�͂������������̔M�Ɋւ��錻�ۂ�ΏۂƂ��镪��ł���B
�Ñ�M���V���ł͂��ׂĂ̕����͉Υ��C�����y����ł��Ă���ƍl���u�̑f�v���l�����Ă����B17���I���ɂ́A�R�����ɂ͔R�f(�t���M�X�g��)�ƌĂ�镨�����܂܂�Ă��āA���̃t���M�X�g�����������邱�Ƃ��u�R����v�Ƃ������Ƃ��ƍl�����Ă����B18���I�ɂȂ������H�A�W�F(1743-94)�͋����Ȃǂ��R�Ă��邱�ƂŎ��ʂ����傷�邱�Ƃ�m��A�R�Ă͎_�f�Ƃ̌����ł���A�R�f�ȂǂƂ������̂͑��݂��Ȃ����Ƃ𖾂炩�ɂ��āA���܂ŔR�Ă͔R�f(�t���M�X�g��)�������o�����Ƃł���Ƃ���Ă����R�f����ے肵���B�܂��A�ނ͌��f�Ƃ݂Ȃ��镨�����R�R�틓���Č��f�\��������B���̒��ɂ͔M�f(�J�����b�N)������A�M�f���̐�삯�ƂȂ����B�Ƃ��낪�A���̂悤�Ɂu�M�͕����ł���v�ƍl����ƁA�ǂ����Ă��C���C�ɂ���Ă��M���������邱�Ƃ�����ł��Ȃ������B18���I���ɂ́A�������疀�C�ɂ���Ă�����ł��M���������邱�Ƃ��킩��͂��߁C�J�����b�N���M�Ȃ�A�J�����b�N���ǂ�ǂ�o���Ă����A������M���������Ȃ��Ȃ��Ă��܂����Ƃ��킩�����B
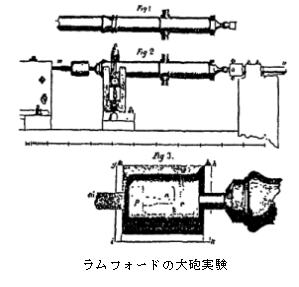
�@�M�Ɖ^���̊W���l�����̂������t�H�[�h�i1753-1814�j�ł������B�ނ͑�C�̒������ƒ��ɑ�ʂɔM����������̂ɋC�Â�(�E�}�Q��)�A�����葕�u�S�̂𐅒��ɓ���A��ƒ��ɂǂꂾ���M����������̂��𑪂����B����ƔM�͑��u�����Â������o�Ă���悤�Ɏv���C���̔M�͔M�f�Ƃ��������ł���Ȃ�ǂ����炫�Ă���̂��ƍl����悤�ɂȂ����B���w�ω������̔M�̋������Ȃ�����A�M�����̌����͉^�������Ȃ��ƍl����悤�ɂȂ�A�M�̉^������[�߂Ă������B
�@�P�X���I�ɂ́C�W���[���i1818�|89�j�C�}�C���[(1814�|78)��ɂ���ĔM�̎��Ԃ����炩�ɂ��ꂽ�B�}�C���[�͉��w�I��p�C�͊w�I�d���C�M�����݂ɓ���ւ��Ƒ������B���̊h�a�����ŔM�Ǝd���̊W���ʉ������B�W���[���́C�d���̔M��p���ʉ����C�d���U���ł̔��M���^�����`��ς������̂ƌ��_�B�h�a���u�ŔM�̎d�����ʂ𑪒�(�E�}�Q��)�C1cal��4.208J���B���̌�C�M�̉^�����͕��q�^���_���瓝�v�͊w�ւƔ��W���Ă����C�M�t�˂̌��ۂ��_�@�ƂȂ��āC�G�l���M�[�͗��U��(�G�l���M�[�ʎq)�ł��邱�Ƃ������ꍡ���Ɏ����Ă���B
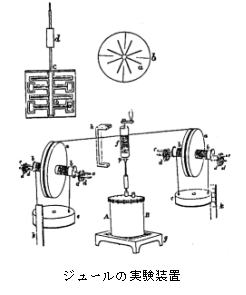
�M�^��������␅�ɗn�����ꂽ�C���N�̗��G�ȉ^���̌����ɂȂ��Ă��錴�q����q�̉^��
�M�������̊��o���ʓI�ɕ\�����̂����x�ł���B����I�ɂ̓Z���V�E�X���x(��)��p����B
�܂��C�Z���V�E�X���xt������
T��t�{273.15 (�P��K) K(�P���r��)�ɂ́��̂悤�Ɂu߁v�͂��Ȃ��B
�Ō��߂��鉷�xT ���Ή��x�Ƃ����B�ȉ��C���L�Ȃ����艷�x�Ƃ͐�Ή��x�������B
�M���t
���x�̈قȂ镨����ڐG�����C�\�����Ԃ��o�߂���ƁC�������̂̔M�^���̃G�l���M�[���ቷ���̂Ɉړ����C�ŏI�I�ɂ͂Q�̕����͓������x�ɂȂ�B���̂悤�ɂQ�����̉��x�����������̊ԂɔM�̈ړ����Ȃ��Ȃ�����Ԃ�M���t�Ƃ���(�����M�͊w��0�@���Ƃ���)�B
�@���̂悤�ɁC���̊Ԃ��ړ�����M�^���̃G�l���M�[��M�Ƃ����B�܂�C�M�^���̃G�l���M�[�̏o���肷���(�ω���)�ł���B
��M
����1[Kg]��1[K]�̉��x�ω�������̂ɕK�v�ȔM�ʂ����̕�������M�ispecific heat�jc�Ƃ����B�܂������̉��x���P[K]�ω�������̂ɕK�v�ȔM�ʂ��M�e��C[J/K]�Ƃ����B�M�e��C�Ɣ�M c [J/Kg�EK]�C����m[Kg]�̊Ԃ�C��mc �̊W������B�܂�C������M�̕����ł����x�ω��̑傫���͎��ʂɂ���ĈقȂ�B
�������ł��C���ʂ��傫���قlj��x�ω��͏��������Ƃ������Ă���(�g�߂ɂ������C��߂ɂ���)�B
�����ɏo���肵���M��Q(J)���C���̂̎���m (Kg)�C���x�ω���t (K)�C���̂̔�M��c (J/Kg�EK)�ŕ\����
�@�@�@�@�@�@Q��mc��t
�̊W������B
�M�ʕۑ��̖@��
�����̕����ƒቷ�̕����Ƃ�ڐG��������C���������ꍇ�C�M���t�ɒB����܂ł�
�@�@�u�����̕����̎������M�ʁ��ቷ�̕����������M�ʁv
�̊W�����藧�B�����M�ʕۑ��̖@���Ƃ����B
�� �M�e�ʂ�5.0�~102J/K�̃A���~�j�E�����̗e��ɁC15���̐�300g������Ă���B�����70���̃A���~�j�E����200g����ꂽ�Ƃ���,�S�̂̉��x��20���ɂȂ����B�� �̔�M��4.2�~103J/Kg�EK�Ƃ���B
�@ �@(1) ���̔M�e�ʁC(2) �A���~�j�E���̔�M�C(3) �e��̎��ʂ����߂�B
�� (1) C��mc��300�~10�|3�~4.2�~103��1260��1.3�~103J/K
�@ �@(2) ���߂��M��c [J/Kg�EK] �Ƃ���ƁC�M�ʕۑ��̖@������
�@�@�@�@�@�@200c (70�|20)��(1260�{5.0�~102)�~(20�|15) �� c ��8.8�~102 [J/Kg�EK]
�@�@(3) C��mc ���� 5.0�~102��m�~8.8�~102 �� m��5.7�~10�|1[Kg]
���M(latent heat)
���̂ɔM��������ƁC���̂̉��x���ω�����B�Ƃ��낪�C�M�̗��ꂪ����̂ɉ��x�ω����Ȃ��ꍇ������B���̌��ۂ́C���̂̕����I�\�����`�Ԃ�ς���Ƃ��ɋN����B����𑊕ω��Ƃ����B
�ő̂���t�̂ւ̑��ω�(�Z��)�C�t�̂���C�̂ւ̑��ω�(�C��)�C�ő̂̌����\���̕ω�������B
���ω�������ꍇ�����G�l���M�[�̕ω����B����m �̏����ȕ����𑊕ω�������̂ɕK�v�ȔM�ʂ� Q��mL �ŗ^������B������L �͂��̕����̐��M�ƌĂ�C�����̎�ށC���ω��̎�ނɂ���ĈقȂ�B
�ő̂���t�֑̂��ω�����ꍇ�̐��M���Z��M�C�t�̂���C�֑̂��ω����ꍇ�̐��M���C���M(�����M)�Ƃ����B�E�}�ɑ��ω��̗�Ƃ��Đ��̏ꍇ�������B
�� �M�e��70J/K�̔M�ʌv��60���̐�200g���ꂽ�B�M�ʌv��0���̕X50g�����Ă���������Ɖ����ɂȂ邩�B�������C���̔�M��4.19J/g�K�C���̗Z��M��334J/g �Ƃ���B
�@�@�@�@�@�@
�� 50g�C0���̕X��0���̐��ɂȂ�Ƃ��̗Z��M�� 50�~334J
50g�C0���̐���t ���̐��ɂȂ�Ƃ��ɋz������M�ʂ�50�~4.19�~(t�|0)J
60���C200g�̐��C�M�ʌv���������M�ʂ� (200�~4.19�{70)�~(60�|t)J
�������M�ʁ������M�ʂ�����
50�~334�{50�~4.19�~(t�|0)�� (200�~4.19�{70)�~(60�|t)
����������� t��33.8��34��
�����t�H�[�h(1753-1814)�̓��{�A�W�F�v�l�ƌ��������B�{��Benjamin Thompson
�Z���V�E�X Celsius Anders[1701-44] �ێ��Ə̂���B�����t�@�[�����n�C�gFahrenheit
Gabriel Daniel[1686-1736]�����≷�x�v���Ɠ����ɉ؎����x(�F)���l�Ă����B�؎��Ɛێ��̕\���͂��ꂼ��A�t�@�[�����n�C�g�̒�����\�L�ł���ؗϊC�ƁA�Z���V�E�X�̒�����\�L�ł���ێ��C�z�ɗR���B F=(9/5)�~C+32�̊W�ɂ���B
1���̉��x�ω���1K�Ƃ����B
�P���r�� Load kelvin(1824-1907)
�{���g���\���v�������������@�s�������������B��Ή��x�̒P�ʂ̓P���r���ɗR������B
�����̔�M�̗�
�~103(25��,1�C��) J/Kg�EK
�@�� (15��) 4 .186 ���Ƴ� 0.900
�@�S 0.448 �� 0.387
�@���� 0 .140 �X(�|5��) 2.090
��ٱٺ�� 2.400 �؍� 1.700
�M�e�ʂ�J.B.Black�� 1762�N�ɖ���
��M��A. L. Lavoisier�� 1789�N�ɖ���
Lavoisier(���{�A�W�F)�̓t�����X�v���̍ہA���Ő����l�̑O�������ď��Y���ꂽ�B
���̔�M���퉷�C�툳�ő傫�����Ƃ͒m���Ă��邪�C������M���傫�������ɂ�H2(15K �t��)�Ő���1.65�{�C298.15K��3.419�{�CHe(298.15K)��1�D24�{�ł���C���̔�M���ő�ł͂Ȃ��B
���̔�M�͉��x�ɂ���ĕω�����B��M-���x�̃O���t������
���M�̗�
���� �Z��M �C���M J/Kg 104 106 �� 33.3 2.26 �_�f 1.38 0.21 �س� 0.52 0.02 �� 8.82 2.33 �� 6.44 1.58 �� 13.4 5.06
�z�[�� ���j���[ �M�Ǝd�� �C�̖̂@�� �C�̕��q�^���_ �����G�l���M�[ �C�̂̏�ԕω� �s�t�ω�
Top